Son átomos cargados (positivos o negativos). Como el núcleo es intocable con las energías que aparecen en las reacciones químicas, la única forma de que un átomo se cargue eléctricamente es quitando o poniendo electrones:
Iones positivos, también llamados cationes, son átomos que han perdido electrones. Cada electrón que pierden es una carga positiva que queda en exceso en el núcleo.
Iones negativos, también llamados aniones, son átomos que han ganado electrones. Cada electrón que ganan es una carga negativa en exceso sobre los protones del núcleo.
Los átomos neutros tienen tantos protones (carga positiva) como electrones (carga negativa). Como ambas partículas tienen la misma carga pero con distinto signo, al tener la misma cantidad de ambas el átomo es neutro. Cuando quitamos electrones quedan más cargas positivas que negativas. Cuando añadimos electrones tenemos más cargas negativas que positivas.
Los isótopos
Los isótopos tienen masa diferente, ya que tienen distinto número de neutrones.
Para nombrarlos se indica su nombre seguido de su número másico; por ejemplo, sodio-23 (Na-23).
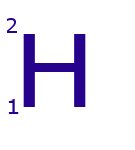
Hidrógeno-1.
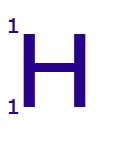
Este isótopo tiene: 1 protón, 1 electrón y 0 neutrones.
Hidrógeno-2.
Este isótopo tiene: 1 protón, 1 electrón y 1 neutrón.
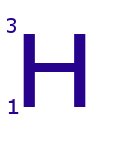
Hidrógeno-3.
Este isótopo tiene: 1 protón, 1 electrón y 2 neutrones.
El número atómico y el número másico
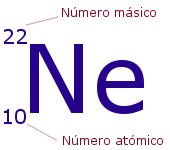
La identidad de un átomo y sus propiedades vienen dadas por el número de partículas que contiene. Lo que distingue a unos elementos químicos de otros es el número de protones que tienen sus átomos en el núcleo. Este número se llama Número atómico y se representa con la letra Z. Se coloca como subíndice a la izquierda del símbolo del elemento correspondiente. Por ejemplo, todos los átomos del elemento Hidrógeno tienen 1 protón y su z = 1, los de helio tienen 2 protones y Z =2, los de litio, 3 protones y Z = 3,…
Si el átomo es neutro, el número de electrones coincide con el de protones y nos lo da Z.
El Número másico nos indica el número total de partículas que hay en el núcleo, es decir, la suma de protones y neutrones. Se representa con la letra A y se sitúa como superíndice a la izquierda del símbolo del elemento. Representa la masa del átomo medida en uma, ya que la de los electrones es tan pequeña que puede despreciarse.
En el ejemplo, tendríamos un átomo del elemento neón, con 10 protones en su núcleo y 10 electrones en su corteza (es neutro). Tendría también: 22-10 = 12 neutrones.
Dmitri Mendeléiev
(08/02/1834 - 02/02/1907)
Dmitri Ivánovich Mendeléiev
Químico ruso
Nació el 8 de febrero 1834 en Tobolsk (Siberia).
Cursó estudios de Química en la Universidad de San Petersburgo y en 1859 en la Universidad de Heidelberg, donde conoció al químico italiano Stanislao Cannizzaro Regresó a San Petersburgo y trabajó como profesor de química en el Instituto Técnico en 1863 y profesor de química general en la Universidad de San Petersburgo en 1866.
Escribió los dos volúmenes de Principios de química (1868-1870). Intentó clasificar los elementos según sus propiedades químicas. En el año 1869 publicó la primera versión de la tabla periódica. En 1871 publicó una versión corregida. También realizó investigaciones en el estudio de la teoría química de la disolución, la expansión térmica de los líquidos y la naturaleza del petróleo.
En el año 1887 comenzó un viaje en globo en solitario para realizar un estudio sobre un eclipse solar.
En 1893 fue nombrado director del departamento de Pesas y Medidas de San Petersburgo.
Dmitri Mendeléiev falleció el 2 de febrero de 1907 en San Petersburgo.

El átomo
Al principio se condideraba al atomo como particula pequeñísima e indivisible. Sin embargo, al estudiarlo con más atención, y a medida que se perfeccionaban y precisaban nuestros métodos de investigación, el átomo resultó poseer una estructura muy compleja.La naturaleza del átomo se manifestó, por primera vez, de forma evidente, cuando el hombre conoció los fenómenos de la radiactividad y comenzó a investigarlos.
En el centro de cada átomo se halla el núcleo, cuyo diámetro es unas cien mil veces más pequeño que el diámetro del átomo.
El núcleo del átomo contiene prácticamente toda la masa del mismo.
El núcleo posee carga eléctrica positiva, cuya magnitud va creciendo al pasar de los elementos químicos ligeros a los pesados.Alrededor de este núcleo cargado positivamente, giran los electrones, cargados negativamente, en número igual al de cargas positivas del núcleo, debido a lo cual, en conjunto, el átomo es neutro desde el punto de vista eléctrico.tivas del núcleo, debido a lo cual, en conjunto, el átomo es neutro desde el punto de vista eléctrico



Suscribirse a:
Comentarios (Atom)